Темы
Андрофлор
14 Октября 2016Болезни мочеполовой системы являются ведущей причиной нарушения репродуктивной функции у мужчин, что имеет огромное социально-экономическое значение, особенно в современных условиях снижения рождаемости.
Наиболее частой причиной болезней мочеполовой системы у мужчин является инфекционно-воспалительный процесс, длительность и интенсивность которого определяет степень нарушений репродуктивной функции: хроническое воспаление оказывает продолжительное токсическое действие на сперматогенный эпителий, нарушает гематотестикулярный барьер, реологические свойства и химический состав семенной жидкости, а также может приводить к развитию аутоиммунных реакций, например к образованию антиспермальных антител.
В процессе развития воспалительной реакции возрастает количество активированных клеток иммунной системы, что сопровождается повышенным образованием свободных радикалов кислорода и увеличением секреции лимфокинов и монокинов, результатом чего является вторичное воспаление в тканях репродуктивного тракта.
Согласно Международной классификации болезней 10-го пересмотра (МКБ-10), в перечень заболеваний мочеполовой системы у мужчин, причиной которых может быть инфекционно-воспалительный процесс, входят:
- N34.1 Неспецифический уретрит
- N34.2 Другие уретриты
- N34.3 Уретральный синдром неуточненный
- N40 Гиперплазия предстательной железы
- N41.0 Острый простатит
- N41.1 Хронический простатит
- N45 Орхит и эпидидимит
- N48.1 Баланопостит
- N48.6 Баланит
- N49.0 Воспалительные болезни семенного пузырька
- N49.1 Воспалительные болезни семенного канатика, влагалищной оболочки и семявыносящего протока
Часто этиологическими факторами развития инфекционно-воспалительного процесса являются облигатные патогены и вирусы: Neisseria gonorrhoeae, Chlamydia trachomatis, Trichomonas vaginalis, Mycoplasma genitalium, Herpes Simplex Virus типов 1 и 2, однако в последние годы отмечается существенное увеличение роли условно-патогенных микроорганизмов: Ureaplasma urealyticum, Ureaplasma parvum, Haemophilus, Candida и др. (табл. 1).
Таблица 1. Микроорганизмы – возбудители заболеваний мочеполовой системы у мужчин (по данным литературы)
| Заболевание | Возможные возбудители заболевания | Источник информации |
|---|---|---|
| Баланит, баланопостит | Neisseria gonorrhoeae
Chlamydia trachomatis Mycoplasma genitalium Trichomonas vaginalis | 8, 17 |
| Bacteroides/Prevotella
Аnaerococcus Peptostreptococcus Clostridium | 9,17 | |
| Gardnerella vaginalis | 17 | |
| Candida | 8,17 | |
| Staphylococcus
Streptococcus | 30 | |
| Уретрит | Neisseria gonorrhoea | 23 |
| Chlamydia trachomatis | 11 | |
| Mycoplasma genitalium | 11 | |
| Trichomonas vaginalis | 7 | |
| Ureaplasma urealyticum | 14, 34, 44 | |
| Ureaplasma parvum | 7 | |
| Haemophilus | 25 | |
| Candida spp. | 29, 35 | |
| Leptotrichia/Sneathia
Megasphaera Clostridium BVAB-2, BVAB-3 | 31 | |
| Staphylococcus
Streptococcus | 26 | |
| Corynebacterium | 19 | |
| Простатит | Chlamydia trachomatis | 38, 44 |
| Ureaplasma urealyticum | 38 | |
| Mycoplasma hominis | 38 | |
| E.сoli
Enterococcus faecalis | 33, 44 | |
| Pseudomonas aeruginosa | 44 | |
| Bacteroides/Prevotella/Porphyromonas | 5, 10, 40 | |
| Burkholderia pseudomallei | 4, 16 | |
| Staphylococcus Streptococcus | 33 | |
| Corynebacterium | 41 | |
| Орхит, эпидидимит | Neisseria gonorrhoeae | 42 |
| Chlamydia trachomatis | 42, 43 | |
| Enterobacteriaceae | 42, 43 | |
| Pseudomonas aeruginosa | 43 |
Значительную роль в нарушении репродуктивного здоровья мужчин играет воспаление предстательной железы. Простатит – самый частый урологический диагноз у мужчин моложе 50 лет и третий по частоте у мужчин старше 50 лет, при этом приблизительно у 10 % мужчин заболевание диагностируется уже на стадии хронического течения [4, 25, 40].
Острый бактериальный простатит (ОБП) чаще всего является результатом восходящей инфекции мочевого тракта или процедур, затрагивающих мочевой тракт, например уретральной катетеризации или трансректальной биопсии простаты. Бактериальный простатит протекает в острой форме с яркими клиническими проявлениями только в 5 % случаев, что требует обязательной лабораторной диагностики при подозрении на заболевание простаты.
Наиболее часто при ОБП определяются бактерии группы Enterobacteriaceae (87 %), другие грамотрицательные бактерии, такие как Pseudomonas aeruginosa, Enterococcus и др., встречаются приблизительно в 10 % случаев. В развитии хронической формы заболевания большое значение имеют анаэробные бактерии, в том числе Bacteroides/ Prevotella/ Porphyromonas, ассоциированные с развитием бактериального вагиноза у женщин, а также Burkholderia.
При хроническом течении заболевания более 70 % случаев также имеют инфекционную этиологию, при этом наиболее распространенными микроорганизмами являются: C. trachomatis (>30 %), T. vaginalis (11 %) и U. urealyticum (5 %) [4, 25, 40].
Секреты мужских половых желез (эякулят, секрет простаты, моча после массажа простаты) в случае возникновения простатита часто содержат обильные полимикробные сообщества, включающие как оппортунистические патогены, так и бактерии-комменсалы. Последние играют двойственную роль в мужском урогенитальном тракте, так как при возникновении определенных условий способны вызывать уретриты и простатиты.
Отсутствие патогномоничной симптоматики инфекционно-воспалительных процессов у мужчин, а также преобладание стертого или асимптомного клинического течения обусловливает необходимость введения в практику информативной диагностической технологии, которая позволяет быстро и достоверно выявить фактор воспалительного процесса и выбрать эффективную, этиологически обоснованную лекарственную терапию.
В настоящее время перечень лабораторных исследований, рекомендованный стандартами оказания медицинской помощи при заболеваниях мочеполовой системы у мужчин, включает бактериологический и микробиологический методы (табл. 2).
Таблица 2. Виды лабораторных исследований для диагностики заболеваний мочеполовой системы у мужчин, рекомендованные в стандартах медицинской помощи
| No п/п | Содержание исследования | Заболевание | Код по МКБ-10 | No Приказа МЗ РФ | Дата Приказа МЗ РФ |
|---|---|---|---|---|---|
| 1 | Бактериологическое исследование отделяемого секрета простаты на аэробные и факультативно-анаэробные условно-патогенные микроорганизмы | Неспецифический уретрит | N34.1 | 1675н | 29.12.2012 |
| Другие уретриты | N34.2 | ||||
| Уретральный синдром неуточненный | N34.3 | 1751н | |||
| Гиперплазия предстательной железы | N40 | 697н | 09.11.2012 | ||
| Острый простатит | N41.0 | 696н | |||
| Хронический простатит | N41.1 | 1673н | 29.12.2012 | ||
| Орхит и эпидидимит | N45 | 696н | 09.11.2012 | ||
| 2 | Микробиологическое исследование мочи на аэробные и факультативно-анаэробные условно-патогенные микроорганизмы | Гиперплазия предстательной железы | N40 | 607н | 09.11.2012 |
| Острый простатит | N41.0 | 696н | |||
| Хронический простатит | N41.1 | 1673н | 29.12.2012 | ||
| Орхит и эпидидимит | N45 | 696н | 09.11.2012 | ||
| Воспалительные болезни семенного пузырька | N49.0 | 1672н | 29.12.2012 | ||
| Воспалительные болезни семенного канатика, влагалищной оболочки и семявыносящего протока | N49.1 | ||||
| 3 | Микробиологическое исследование отделяемого из уретры на микоплазмы (Mycoplasma genitalium) и уреаплазму (Ureaplasma urealyticum) | Неспецифический уретрит | N34.1 | 1675н | 29.12.2012 |
| Другие уретриты | N34.2 | ||||
| Уретральный синдром неуточненный | N34.3 | 1751н | 29.12.2012 | ||
| Воспалительные болезни семенного пузырька | N49.0 | 1672н | 29.12.2012 | ||
| Воспалительные болезни семенного канатика, влагалищной оболочки и семявыносящего протока | N49.1 | ||||
| 4 | Молекулярно-биологическое исследование отделяемого из уретры на хламидии (Chlamidia trachomatis) | Неспецифический уретрит | N34.1 | 1675н | 29.12.2012 |
| Другие уретриты | N34.2 | ||||
| Уретральный синдром неуточненный | N34.3 | 1751н | 29.12.2012 | ||
| Острый простатит | N41.0 | 696н | 09.11.2012 | ||
| Орхит и эпидидимит | N45 | ||||
| Баланопостит | N48.1 | 1684н | 29.12.2012 | ||
| Баланит | N48.6 | ||||
| Воспалительные болезни семенного пузырька | N49.0 | 1672н | 29.12.2012 | ||
| Воспалительные болезни семенного канатика, влагалищной оболочки и семявыносящего протока | N49.1 | ||||
| 5 | Микроскопическое исследование отделяемого из уретры на гонококк (Neisseria gonorrhoeae) | Неспецифический уретрит | N34.1 | 675н | 29.12.2012 |
| Другие уретриты | N34.2 | ||||
| Уретральный синдром неуточненный | N34.3 | 1751н | 29.12.2012 | ||
| Острый простатит | N41.0 | 696н | 09.11.2012 | ||
| Орхит и эпидидимит | N45 | ||||
| Баланопостит | N48.1 | 1684н | 29.12.2012 | ||
| Баланит | N48.6 | ||||
| Воспалительные болезни семенного пузырька | N49.0 | 1672н | 29.12.2012 | ||
| Воспалительные болезни семенного канатика, влагалищной оболочки и семявыносящего протока | N49.1 | ||||
| 6 | Микроскопическое исследование отделяемого из уретры на гарднереллы (Gardnerella vaginalis) | Неспецифический уретрит | N34.1 | 1675н | 29.12.2012 |
| Другие уретриты | N34.2 | ||||
| Уретральный синдром неуточненный | N34.3 | 1751н | 29.12.2012 | ||
| Баланопостит | N48.1 | 1684н | 29.12.2012 | ||
| Баланит | N48.6 | ||||
| 7 | Паразитологическое исследование секрета простаты на трофозоиты трихомонад (Trichomonas vaginalis) | Неспецифический уретрит | N34.1 | 1675н | 29.12.2012 |
| Другие уретриты | N34.2 | ||||
| Уретральный синдром неуточненный | N34.3 | 1751н | 29.12.2012 | ||
| 8 | Микологическое исследование отделяемого из уретры на грибы рода кандида (Candida spp.) | Баланопостит | N48.1 | 1684н | 29.12.2012 |
| Баланит | N48.6 |
На данный момент культуральный и микроскопический методы рассматриваются в международной и российской лабораторной практике как имеющие ряд существенных ограничений, которые затрудняют получение объективного результата обследования.
Метод микроскопии – самый быстрый и дешевый, его использование связано с минимальными требованиями к организации лаборатории. Однако использование микроскопии для диагностики инфекционных заболеваний сопряжено:
- с низкой чувствительностью метода;
- с субъективностью оценки результатов;
- с ограниченным спектром выявляемых морфотипов;
- с приблизительной количественной оценкой.
Так, при диагностике трихомониаза микроскопический метод имеет самую низкую чувствительность: в среднем 30 % (для женщин – 50–60 %, для мужчин – 10–12 %), тогда как метод ПЦР достоверно определяет возбудителя в 90–96 % случаев (Sexually Transmitted Diseases Treatment Guidelines, CDC, 2010).
Национальный центр по предупреждению заболеваний (CDC, USA) с 2006 г. для диагностики трихомониаза у мужчин не рекомендует применение микроскопиии, указывает на информативность культурального исследования выделений, мочи и спермы.
Особенно затруднительна диагностика в случае низкокопийных препаратов или биоматериала, содержащего значительное количество клеток эпителия и лейкоцитов. При сравнении чувствительности микроскопических методов исследования и ПЦР показано, что частота выявляемости N. gonorrhoeae при микроскопии у мужчин – 80–95 %, у женщин – 30–50 %, C. trachomatis – 10–12 %; использование метода ПЦР дает возможность определять указанные микроорганизмы с чувствительностью более 95 % [6, 28, 36, 39, 46].
Кроме того, при микроскопии мазков можно идентифицировать микроорганизмы, присутствующие в биоматериале в количестве выше 105 КОЕ/мл, тогда как многие факультативно-анаэробные и аэробные бактерии могут проявлять патогенный эффект при сравнительно небольшом количестве (до 104 КОЕ/мл), которое не выявляется при микроскопии. Данные обстоятельства существенно снижают диагностическую ценность микроскопического исследования.
Метод ПЦР с детекцией результатов в режиме реального времени (ПЦР-РВ) позволяет выявлять ДНК/РНК микроорганизмов вне зависимости от их культуральных и морфологических особенностей, в том числе микроорганизмов, не поддающихся культивированию; охарактеризовать структуру микробиоты соответствующего биотопа для оценки патогенетической роли каждой группы микроорганизмов у данного пациента.
Комбинация высокой чувствительности и специфичности, скорость (1-1,5 часа) получения результата, возможность количественного анализа и диагностики некультивируемых микроорганизмов делают технологию ПЦР-РВ максимально удобной и клинически значимой в исследовании инфекционных заболеваний.
Количественный анализ микроорганизмов с помощью ПЦР-РВ в настоящее время используется для изучения нормальной, патогенной и условно-патогенной микрофлоры в разных биотопах человека: периодонте [20], респираторном тракте [47], образцах из желудочно-кишечного тракта [18] и вагинального микробиома у женщин [27].
Подобный подход использован в Наборе реагентов для исследования биоценоза урогенитального тракта у женщин методом ПЦР в режиме реального времени «Фемофлор®». Исследования «Фемофлор®» защищены патентом (No 2008 105 063 от 13.02.2008 «Способ диагностики дисбаланса микробиоты различных биотопов человека и степени его выраженности»), разрешены к применению на территории РФ (регистрационное удостоверение No ФСР 2009/04663 от 01.04.2009), ежегодно с 2011 года вводятся в Перечень видов высокотехнологичной медицинской помощи по профилю «Акушерство и гинекология». Получено РАЗРЕШЕНИЕ ФС No2011/375 от 22 ноября 2011 г. на применение новой медицинской технологии «Применение метода полимеразной цепной реакции в реальном времени для оценки микробиоценоза урогенитального тракта у женщин (тест «Фемофлор®»)».
В 2014 г. авторский коллектив врачей и ученых под руководством генерального директора группы компаний «ДНК-Технология» д.б.н. Д. Ю. Трофимова был признан победителем Национальной медицинской премии лучшим врачам России «Призвание» в номинации «За создание нового метода диагностики» – технологии «Фемофлор®».
В настоящее время актуальным направлением в исследовании биоценозов является сравнение микробного состава УГТ половых партнеров с целью разработки эффективного алгоритма лабораторного обследования пар и подбора терапии в случае выявления у одного/обоих партнеров заболеваний репродуктивной системы инфекционной этиологии либо нарушений репродуктивной функции.
Например, при обследовании половых партнеров пациенток с бактериальным вагинозом морфотипы ассоциированных с бактериальным вагинозом микроорганизмов выявлялись у 25 % мужчин, при этом клинические проявления (баланопостит) наблюдались у 3 % пациентов. Кроме того, условно-патогенные микроорганизмы – потенциальные возбудители воспалительных заболеваний УГТ могут попадать в уретру при анальных и орогенитальных контактах, что создает опасность заражения обоих половых партнеров.
Принимая во внимание клиническую и социальную значимость заболеваний мочеполовой системы у мужчин, часто стертого или асимптомного течения, а также важность равноценного обследования обоих половых партнеров при нарушениях репродуктивной функции и наличии заболеваний урогенитального тракта, компания «ДНК-Технология» разработала и внедрила уникальную технологию «Андрофлор®», которая позволяет осуществлять диагностику инфекционно-воспалительных заболевания мочеполовой системы у мужчин (табл. 3).
Таблица 3. Наборы реагентов для исследования микрофлоры урогенитального тракта мужчин методом ПЦР в режиме реального времени «Андрофлор®», «Андрофлор® Скрин»
| Наименование набора | Формат детекции | РУ | Назначение* | |||
|---|---|---|---|---|---|---|
| Форез | Flash | Rt | qPCR | |||
| Набор реагентов для исследования микрофлоры урогенитального тракта мужчин методом ПЦР в режиме реального времени «Андрофлор®» | - | - | - | - | - | RUO |
| Набор реагентов для исследования микрофлоры урогенитального тракта мужчин методом ПЦР в режиме реального времени «Андрофлор® Скрин» | - | - | - | - | - | RUO |
* Примечания: RUO – наборы реагентов не имеют регистрационного удостоверения, облагаются НДС 18 %
«Андрофлор®» – это:
- идентификация возбудителей инфекций, передающихся половым путем (ИППП);
- анализ условно-патогенных микроорга- низмов, которые могут присутствовать в мочеполовом тракте мужчин или вызывать инфекционно-воспалительные заболевания мочеполовой системы;
- определение этиологии инфекционного процесса;
- возможность прогнозирования объема назначаемой терапии;
- возможность проведения динамических наблюдений;
- контроль качества взятия биоматериала (количественная оценка геномной ДНК человека).
Одно исследование микрофлоры урогенитального тракта мужчин методом ПЦР в режиме реального времени «Андрофлор®» позволяет полностью заменить комплекс методов ПЦР-РВ, предлагаемых в стандартах медицинской помощи, которые утверждены Минздравом России в 2012 г., а также расширить его за счет дополнительной диагностики облигатных анаэробов.
Варианты комплектации набора «Андрофлор®» зависят от количества выявляемых микроорганизмов (табл. 4).
Таблица 4. Показатели, определяемые Набором реагентов для исследования микрофлоры урогенитального тракта мужчин методом ПЦР в режиме реального времени «Андрофлор®»
| Показатель | Андрофлор® | Андрофлор® Скрин |
|---|---|---|
| Геномная ДНК человека (ГДЧ) | + | + |
| Общая бактериальная масса (ОБМ) | + | + |
| Lactobacillus spp. | + | + |
| Staphylococcus spp. | + | + |
| Streptococcus spp. | + | + |
| Corynebacterium spp. | + | + |
| Gardnerella vaginalis | + | + |
| Atopobium cluster | + | - |
| Megasphaera spp./Veilonella spp./Dialister spp. | + | - |
| Sneathia spp./Leptotrihia spp. /Fusobacterium spp. | + | - |
| Ureaplasma urealyticum | + | + |
| Ureaplasma parvum | + | + |
| Mycoplasma hominis | + | + |
| Bacteroides spp./Porphyromonas spp./Prevotella spp. | + | - |
| Anaerococcus spp. | + | - |
| Peptostreptococcus spp./Parvimonas spp./Eubacterium spp. | + | - |
| Pseudomonas aeruginosa/Ralstonia spp./Burkholderia spp. | + | - |
| Heamophilus spp. | + | -
|
| Enterobacteriaceae/Enterococcus spp. | + | + |
| Candida spp. | + | + |
| Mycoplasma genitalium | + | + |
| Trichomonas vaginalis | + | + |
| Neisseria gonorrhoeae | + | + |
| Chlamydia trachomatis | + | + |
Назначение технологии «Андрофлор®»:
- Технология «Андрофлор®» предназначена для диагностики и мониторинга эффективности лечения любых инфекционно-воспалительных заболеваний мочеполовой системы у мужчин.
- Технология «Андрофлор® Скрин» предназначена для диагностики и мониторинга лечения острых инфекционно-воспалительных заболеваний мочеполовой системы у мужчин.
Материал для исследования
ВНИМАНИЕ! Для исключения искажений результатов определения состава микрофлоры урогенитального тракта мужчин из-за присутствия в урогенитальном тракте транзиторной микрофлоры в течение трех дней перед взятием биоматериала рекомендуется половое воздержание или защищенный половой контакт.
- Для этиологической диагностики уретрита, баланопостита, мониторинга терапии данных заболеваний рекомендованными видами биологического материала являются: соскоб из уретры, соскоб с крайней плоти головки полового члена (ГПЧ), моча (первая порция утренней мочи используется только для идентификации патогенов).
- Для этиологической диагностики простатита, мужского бесплодия, мониторинга терапии данных заболеваний рекомендованными видами биологического материала являются: секрет (сок) простаты*, остаточная моча после массажа простаты, эякулят, биопсийный материал из ткани простаты.
*При подозрении на острый простатит выполнять массаж простаты категорически запрещено!
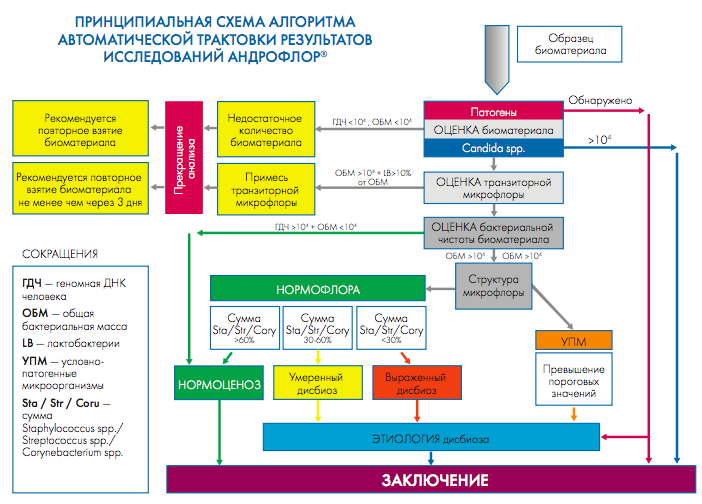
Интерпретация результатов исследования формируется согласно алгоритму (рис. 1).
Рис. 1. Принципиальная схема алгоритма автоматической трактовки результатов
Аналитическая чувствительность:
- для всех, кроме Mycoplasma genitalium, Trichomonas vaginalis, Neisseria gonorrhoeae, Chlamydia trachomatis, – 4000 копий/мл;
- для Mycoplasmagenitalium,Trichomonasvaginalis,Neisseriagonorrhoeae,Chlamydiatrachoma- tis – 1000 копий/мл.
Формат наборов: наборы раскапаны в стрипованные пробирки (8 шт. по 0,2 мл).
Температура хранения: компоненты набора следует хранить при температуре от 2 °С до 8 °С в течение всего срока годности.
Срок годности:12 месяцев.
Наборы реагентов для выделения ДНК: ПРОБА-НК-ПЛЮС; ПРОБА-ГС-ПЛЮС.
Оборудование, необходимое для проведения анализа: приборы серии ДТ производства ООО «НПО ДНК-Технология» (ДТлайт, ДТпрайм, ДТ-96).
Для проведения анализа с использованием стрипованных пробирок необходимо дополнительное оборудование: штатив и насадка на микроцентрифугу (вортекс) для стрипованного пластика.
Особенности набора:
- Одновременная детекция (мультиплексный анализ) – в одной пробирке определяется несколько ДНК-мишеней.
- Внутренний контрольный образец (ВК) присутствует в каждой пробирке с амплификационной смесью, необходим для контроля прохождения полимеразной цепной реакции.
- Геномная ДНК человека (ГДЧ) требуется для анализа качества взятия исследуемого материала.
- Маркер используется прибором для определения положения стрипованных пробирок (стрипов) в плашке.
Приборы серии ДТ производства компании «ДНК-Технология» оснащены специально разра- ботанным русскоязычным программным обеспечением (ПО), поддерживающим автоматическую обработку данных и выдачу результатов исследования в удобной для интерпретации форме (рис. 2).
Рис. 2. Приборы серии ДТ: А. Амплификатор детектирующий ДТпрайм Б. Амплификатор детектирующий ДТлайт

Уникальные технические характеристики приборов позволяют существенно сократить общее время проведения анализа. Это значительно экономит время исследования и обеспечивает высокую пропускную способность лаборатории.
Существенным преимуществом ПО является возможность одновременной реализации качественного и количественного мультиплексного анализа.
Кроме того, программа позволяет выдавать результаты в удобной и наглядной форме для анализа полученных данных врачами-клиницистами (рис. 3).
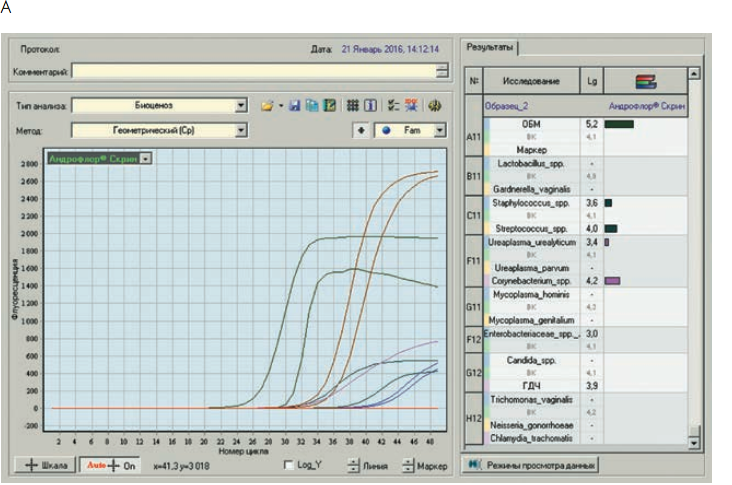
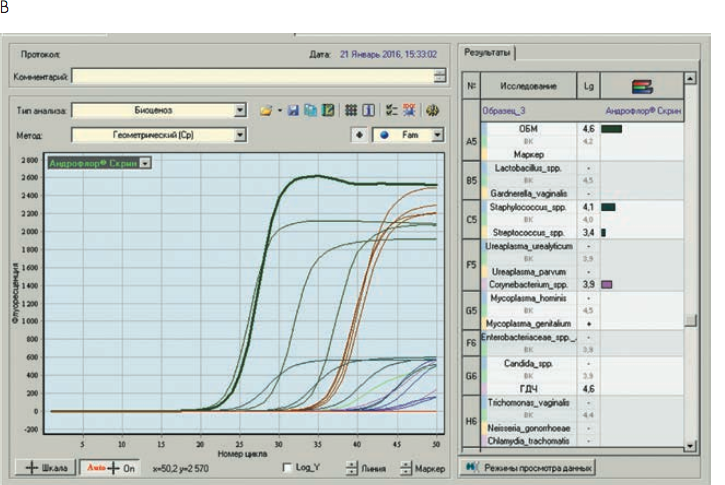
Рис. 3. Бланки выдачи результатов «Андрофлор®» в формате Rt (приборы серии ДТ). А, В – анализ оптических измерений (канал Fam). Б, Г – бланки выдачи результатов
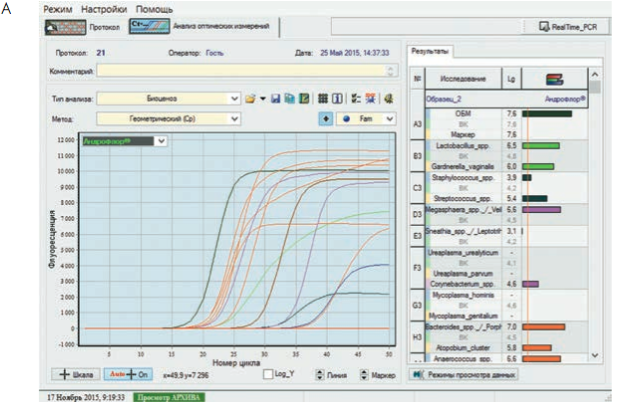
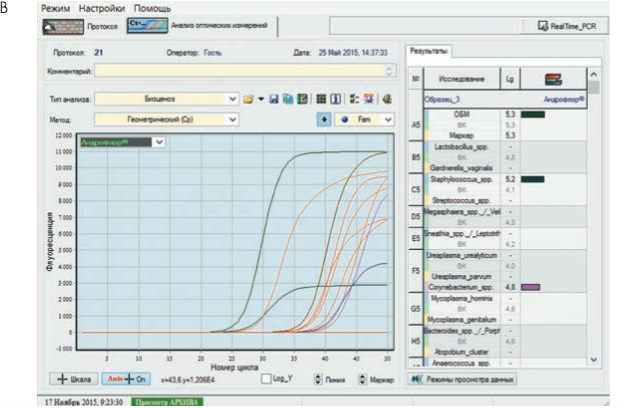
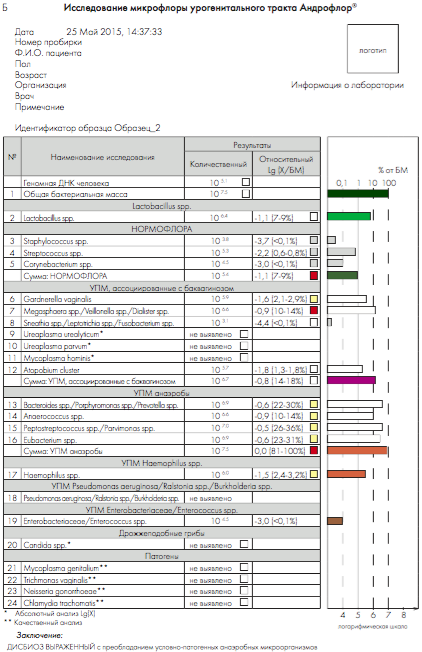
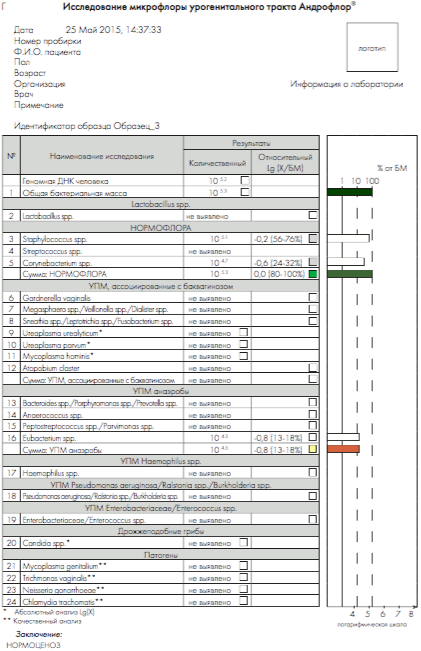
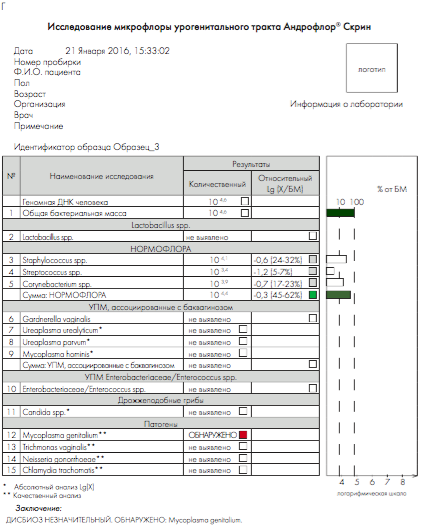
Рис 4. Бланки выдачи результатов «Андрофлор® Скрин» в формате Rt (приборы серии ДТ). А, В – анализ оптических измерений (канал Fam). Б, Г – бланки выдачи результатов

Литература
- Болдырева М. Н., Липова Е. В., Алексеев Л. П. и др. Характеристика биоты урогенитального тракта у женщин репродуктивного возраста методом ПЦР в режиме реального времени // Журнал акушерства и женских болезней. – 2009. – No LVIII. – Выпуск 6. – С. 36-42.
- Ворошилина Е. С., Тумбинская Л. В., Донников А. Е. и др. Биоценоз влагалища с точки зрения количественной ПЦР: изменения и коррекция во время беременности //Уральский медицинский журнал. – 2010. – No 03(68). – С. 108-111.
- Шипицына Е. В., Мартикайнен З. М., Воробьева Н. Е. и др. Применение теста Фемофлор для оценки микробиоценоза влагалища //Журнал акушерства и женских болезней. – 2009. – No 3. – С. 38-44.
- Arzola J. M, Hawley J. S., Oakman C. et al. A case of prostatitis due to Burkholderia Pseudomallei //Nat Clin Pract Urol. – 2007. – Vol.4. – No 2. – P. 111-114.
- Berger R. E., Krieger J. N., Rothman I., et al. Bacteria in the prostate tissue of men with idiopathic prostatic inflammation // J Urol. – 1997. – Vol. 157. – No 3. – P. 863-865.
- Bignell C., Unemo M. 2012 European guideline on the diagnosis and treatment of gonorrhoea in adults//Int J STD AIDS – 2013. – Vol. 24. – No2. – P. 85-92.
- Borchardt KA, al-Haraci S, Maida N. Prevalence of Trichomonas vaginalis in a male sexually transmitted disease clinic population by interview, wet mount microscopy, and the InPouch TV test // Genitourin Med. – 1995. – Vol. 71. – No 6. – P. 405-406.
- Borelli S, Lautenschlager S. Differential diagnosis and management of balanitis // Hautarzt. – 2015. – Vol. 66. – No 1. – P. 6-11.
- Boyanova L., Mitev A., Gergova G. et al. High prevalence and resistance rates to antibiotics in anaerobic bacteria in specimens from patients with chronicbalanitis //Anaerobe. – 2012. – Vol. 18. – No 4. – P. 414-416.
- Brook I. Urinarytract and genito-urinary suppurative infections due to anaerobic bacteria // Int J Urol.– 2004.– Vol.11.–No3.– P.133-141.
- Busolo F., Camposampiero D., Bordignon G., et al. Detection of Mycoplasma genitalium and Chlamydia trachomatis DNAs in male patients with urethritis using the polymerase chain reaction // New Microbiol. – 1997. – Vol. 20. – No 4. – P. 325-332.
- Clifford R. J., Milillo M., Prestwood J. et al. Detection of bacterial 16S rRNA and identification of four clinically important bacteria by real-time PCR // PLoS One.–2012.–Vol.7.–No11.–P.48558.
- Cockerill, F.R. Application of rapid cyclereal timepoly merasecha inreaction for diagnostic testing in the clinical microbiology laboratory // Arch. Pathol. Lab. Med. – 2003. – Vol. 127. – No 7. – P. 1112–1120.
- Deguchi T., Yoshida T., Miyazawa T. et al. Association of Ureaplasma urealyticum (biovar 2) with nongonococcal urethritis //Sex Transm Dis. – 2004. – Vol. 31. – No 3. – P. 192–195.
- Deguchi T., Shimada Y., Horie K. etal. Bacterial loads of Ureaplasma parvum contribute to the development ofinflammatory responses in the male urethra // Int J STD AIDS. – 2015. – Vol. 26. – No 14. – P. 1035-1039.
- Demar M., Ferroni A., Dupont B. et al. Suppurative Epididymo-orchitis and Chronic Prostatitis Caused by Burkholderia pseudomallei: A Case Report and Review // J Travel Med. – 2005. – Vol. 12. – No 2. – P. 108–112.
- Edwards S. Balanitis and balanoposthitis: areview // Genitourin Med. – 1996. – Vol.72. – No3. – P.155–159.
- Espy M. J., Uhl J. R., Sloan L. M. et al. Real-time PCR in clinical microbiology: applications for routine laboratory testing // Clin Microbiol Rev. – 2006. – Vol. 19. – No 1. – P. 165-256.
- Furness G., Evangelista A. T. Infection of a nonspecific urethritis patient and his consort with a pathogenic species of nonspecific urethritis Corynebacteria, Corynebacterium genitalium, N. SP //Invest Urol. – 1976. – Vol. 14. – No 3. – P. 202-205.
- Guglielmetti M. R., Rosa E. F., Lourenção D. S. et al. Detection and quantification of periodontal pathogens in smokers and never-smokers with chronic periodontitis by real-time polymerase chain reaction. // J Periodontol. – 2014. – Vol. 85. – No 10. – P. 1450-1457.
- Haarman M., Knol J. Quantitative real-time PCR assays to identify and quantifyfecal Bifidobacterium species in infants receiving a prebiotic infant formula// Appl Environ Microbiol. – 2005. – Vol. 71. – No 5. – P. 2318-2324.
- Heid C.A.,Stevens J.,Livak K.J. et al.Real time quantitative PCR // Genome Res.–1996.–Vol.6.–No10.–P.986-994.
- Hooton T.M., Barnes R.C.Sexually transmitted diseases. Urethritis in men // Infect Dis Clin North Am.–1987.–Vol.1.–No1.–P.165-178.
- Horváth Á., Pető Z., Urbán E. et al. A novel, multiplex, real-time PCR-based approach for the detection of the commonly occurring pathogenic fungi and bacteria //BMC Microbiol. – 2013. – Vol. 13. – P. 300.
- Hsu M. S., Wu M. Y., Lin T. H. et al. Haemophilus parainfluenzae urethritis among homosexual men // J Microbiol Immunol Infect. – 2015 . – Vol. 48. – No 4. – P. 450-452.
- Ivanov Y.B. Microbiological features of persistentnon specific urethritisinmen // J Microbiol Immunol Infect.–2007.–Vol.40.–No2.–P.157-161.
- Jespers V., Menten J., Smet H. et al. Quantification of bacterial species of the vaginal microbiome in different groups of women, using nucleic acid amplification tests // BMC Microbiol. – 2012;12:83.
- Lanjouw E., Ossewaarde JM., Stary A. 2010 European guideline for the management of Chlamydia trachomatis infections //Int J STD AIDS. – 2010. – Vol. 21. – No 11. – Р. 729-737.
- Lefevre J. C., Lepargneur J. P., Bauriaud R. et al. Clinical and microbiologic features of urethritis in men in Toulouse, France // Sex Transm Dis. – 1991. – Vol.18.–No2.–P.76-79.
- Lisboa C., Ferreira A., Resende C. et al. Infectious balanoposthitis: management, clinical and laboratory features //Int J Dermatol. – 2009. – Vol.48. – No 2. – P. 121-124.
- Manhart L. E., Khosropour C. M., Liu C. et al. Bacterial Vaginosis – Associated Bacteria in Men: Association of Leptotrichia / Sneathia spp. with Nongonococcal Urethritis // Sex Transm Dis. – 2013. – Vol. 40. – No 12. – P. 944–949.
- Melendez J. H., Frankel Y. M., An A. T. et al. Real-time PCR assays compared to culture-based approaches for identification of aerobic bacteria in chronic wounds //Clin Microbiol Infect. – 2010. – Vol. 16. – No 12. – P. 1762-1769.
- Nickel J. C., Xiang J. Clinical significance of nontraditional bacterial uropathogens in the management of chronic prostatitis // J Urol. – 2008. – Vol. 179. – No 4. – P. 1391-1395.
- Ondondo R.O., Whittington W.L., Astete S.G. et al. Differential association of ureaplasma species with non-gonococcal urethritisin heterosexual men // Sex Transm Infect. – 2010. – Vol. 86. – No 4. – P. 271–275.
- Orellana M.A., Gómez M.l., Sánchez M.T. etal. Diagnosis of urethritis in men. A 3-year review // Rev Esp Quimioter. – 2009. – Vol.22. – No2. – P.83-87.
- Patel S.R., Wiese W, Ohl C. et al. Systematic review of diagnostic tests for vaginal trichomoniasis // Infect Dis Obstet Gynecol. – 2000. – Vol.8. – No5-6. – Р. 248-257
- Pernica J.M., Moldovan I., Chan F. et al. Real-time polymerase chain reaction for microbiological diagnosis of parapneumonic effusions in Canadian children // Can J Infect Dis Med Microbiol. – 2014. – Vol. 25. – No 3. – P. 151-154.
- Schneider H., Ludwig M., Hossain H. M. et al. The 2001 Giessen Cohort Study on patients with prostatitis syndrome – an evaluation of inflammatory status and search for microorganisms 10 years after a first analysis //Andrologia. – 2003. – Vol. 35. – No 5. – P. 258-262.
- Shahmanesh M., Moi H., Lassau F. et al. 2009 European guideline on the management of male non-gonococcal urethritis //Int J STD AIDS. – 2009. – Vol. 20. – No 7. – P. 458-464.
- Szöke I., Török L., Dósa E. et al. The possible role of anaerobic bacteriain chronic prostatitis // Int J Androl. – 1998. – Vol.21. – No3. – P.163-168.
- Türk S. ,Korrovits P., Punab M. et al. Coryneform bacteriain semen of chronic prostatitis patients//IntJAndrol.–2007.–Vol.30.–No2.–P.123-128.
- Walker N. A., Challacombe B. Managing epididymo-orchitisin general practice // Practitioner. – 2013. – Vol.257(1760): 21-5,2-3.
- Weidner W., Schiefer H. G., Garbe C. Acute nongonococcal epididymitis. Aetiological and therapeutic aspects //Drugs. – 1987. – Vol. 34. – Suppl 1. – P. 111-117.
- Weidner W., Schiefer H.G., Krauss H. et al. Chronic prostatitis: a thorough search for etiologically involved microorganisms in 1,461patients // Infection.– 1991 – Vol. 19. – Suppl 3. – P. 119-125.
- Wetmore C.M., Manhart L.E., Lowens M.S. et al. Ureaplasma urealyticum is associated with nongonococcal urethritis among men with fewer lifetime sexual partners: A case-control study //J Infect Dis. – 2011. – Vol. 204. – No 8. – P. 1274–1282.
- Workowski K.A, Bolan G.B // Sexually Transmitted Diseases Treatment Guidelines, 2015 // MMWR. – 2015. – Vol.64. – No3. – P.1-138.
- Zemanick E.T., Wagner B.D., Sagel S.D., Stevens M.J. Reliability of quantitative real-time PCR for bacterial detection in cystic fibrosis airway specimens. // PLoS One. – 2010. – Vol.30. – No5(11). – P.15101.
